Maria Gpe. Quintero Peña
martes, 27 de noviembre de 2012
lunes, 26 de noviembre de 2012
RESUMEN SEMANA 11
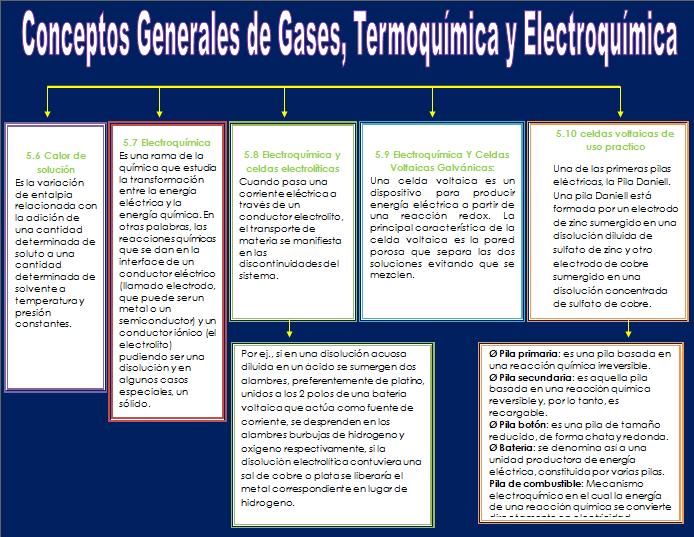
5.6 Calor de solución
Es la variación de entalpia relacionada con la adición de una cantidad determinada de soluto a una cantidad determinada de solvente a temperatura y presión constantes.
El proceso de disolución del Cloruro de Sodio en agua requiere energía, ya que deben separarse el Na+ y el Cl- que se encuentran unidos por fuerzas electrostáticas en el cristal y posteriormente solvatarse en el solvente quedando al estado de iones en la solución. El balance energético de estos procesos puede dar un resultado positivo o negativo, es decir, en algunos casos se requiere energía para disolver un sólido y en otros casos se desprende energía, también en forma de calor. En el caso particular de una disolución, el calor desprendido o absorbido se llama “Calor de Disolución”, o mejor “Entalpía de Solución”, D Hsoln.
El proceso de disolución del Na Cl en agua, se puede representar por:
Na Cl (s) —H2O→ Na+ (ac) + Cl- (ac) D Hsoln = 4,0 kJ
5.7 Electroquímica
Electroquímica es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química. En otras palabras, las reacciones químicas que se dan en la interface de un conductor eléctrico (llamado electrodo, que puede ser un metal o un semiconductor) y un conductor iónico (el electrolito) pudiendo ser una disolución y en algunos casos especiales, un sólido.
Si una reacción química es conducida mediante una diferencia de potencial aplicada externamente, se hace referencia a una electrólisis. En cambio, si la caída de potencial eléctrico, es creada como consecuencia de la reacción química , se conoce como un "acumulador de energía eléctrica", también llamado batería o celda galvánica.
Las reacciones químicas donde se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o en caso contrario, son producidos como consecuencia de ella.
En general, la electroquímica se encarga de estudiar las situaciones donde se dan reacciones de oxidación y reducción encontrándose separadas, físicamente o temporalmente, se encuentran en un entorno conectado a un circuito eléctrico. Esto último es motivo de estudio de la química analítica, en una subdisciplina conocida como análisis potenciométrico.
5.8 Electroquímica y celdas electrolíticas
Cuando pasa una corriente eléctrica a través de un conductor electrolito, el transporte de materia se manifiesta en las discontinuidades del sistema. Por ej., si en una disolución acuosa diluida en un ácido se sumergen dos alambres, preferentemente de platino, unidos a los 2 polos de una batería voltaica que actúa como fuente de corriente, se desprenden en los alambres burbujas de hidrogeno y oxigeno respectivamente, si la disolución electrolítica contuviera una sal de cobre o plata se liberaría el metal correspondiente en lugar de hidrogeno. Los fenómenos asociados con la electrólisis fueron estudiados por Faraday y la nomenclatura que utilizó y que se emplea todavía fue ideado por Whewell.
Las celdas electroquímicas se usan principalmente con dos fines:
Convertir la energía química en eléctrica
Convertir la energía eléctrica en química
En las pilas secas comunes y en el acumulador de plomo tenemos convertidores de energía química en eléctrica, mientras que en la carga de la batería de almacenamiento y en la purificación electrolítica del cobre se utiliza la energía eléctrica para realizar una acción química. Una celda es un dispositivo simple de dos electrodos y un electrolito capaz de dar electricidad por la acción química dentro de la celda, o de producir una acción química por el paso de electricidad a su través. Una batería, por otra parte, es una combinación de dos o más celdas dispuestas en serie o en paralelo. Así el acumulador de plomo es una batería constituidas por tres celdas conectadas en serie.
El método más común de determinar la diferencia de potencial entre dos puntos cualesquiera en un circuito eléctrico es el de conectar un voltímetro entre aquellos, leyéndose directamente el voltaje con el instrumento.
5.9 Electroquímica Y Celdas Voltaicas Galvánicas:
Una celda voltaica es un dispositivo para producir energía eléctrica a partir de una reacción redox. La principal característica de la celda voltaica es la pared porosa que separa las dos soluciones evitando que se mezclen. La pared es porosa para que los iones la atraviesen. La hemicelda del ánodo adquiere un exceso de iones de Zn positivos (para mantener la neutralidad eléctrica necesita iones negativos), al mismo tiempo, la hemicelda del cátodo consume iones de Cu (para mantener la neutralidad,éste debe eliminar iones negativos).Los iones SO4= atraviesan la pared porosa para satisfacer la neutralidad eléctrica de ambas hemiceldas.
Los tipos de celdas más comunes son: las pilas y el acumulador de plomo.
Una celda voltaica aprovecha la electricidad de la reacción química espontánea para encender una lamparita, es decir, convierte energía potencial química en energía eléctrica (fig. 6). Las tiras de cinc y cobre, dentro de disoluciones de ácido sulfúrico diluido y sulfato de cobre respectivamente, actúan como electrodos (el derecho actúa como cátodo y el izquierdo como ánodo). El puente salino (en este caso cloruro de potasio) permite a los electrones fluir entre las cubetas sin que se mezclen las disoluciones. Cuando el circuito entre los dos sistemas se completa (como se muestra a la derecha), la reacción genera una corriente eléctrica.
Si ambas soluciones se conectan mediante un voltímetro su lectura acusará 1,10 V, esto debido a que el potencial de oxidación del Zn++ es 0,763 V y el del Cu++ es de −0,337 V, por lo tanto el cinc (de mayor potencial) le cede electrones al cobre (de menor potencial).
Obsérvese que el metal de la tira de cinc se consume (oxidación) y la tira desaparece. La tira de cobre crece al reaccionar los electrones con la disolución de sulfato de cobre para producir metal adicional (reducción). Si se sustituye la lamparita por una batería la reacción de una se invertirá, creando una celda electrolítica, convirtiendo energía eléctrica en energía potencial química.
5.10 Celdas voltaicas de uso practico
Tipos de pila
Una de las primeras pilas eléctricas, la Pila Daniell. Una pila Daniell está formada por un electrodo de zinc sumergido en una disolución diluida de sulfato de zinc y otro electrodo de cobre sumergido en una disolución concentrada de sulfato de cobre. Ambas disoluciones están separadas por una pared porosa. En esta situación la tensión de disolución del zinc es mayor que la presión osmótica de los iones Zn++ y el electrodo se disuelve emitiendo Zn++ y quedando cargado negativamente. En la disolución de sulfato de cobre, debido a su alta concentración de iones Cu, depositándose Cu++ sobre el electrodo de este metal que de este modo queda cargado positivamente. En estas condiciones existirá una diferencia de potencial de 1 voltio aproximadamente entre ambos electrodos.
Similar a la anterior es la Pila de Volta, considerada la primera en su especie. En esta los electrodos son también zinc y cobre y el electrolito es ácido sulfúrico. Al disolverse ambos metales en el ácido, el cobre adquiere un potencial mayor que el zinc, estableciéndose por tanto una diferencia de potencial de aproximadamente 1 voltio entre ambos. Esta pila tiene el inconveniente de que al desprenderse hidrógeno en el proceso, este se deposita en parte sobre el cobre impidiendo el paso de corriente, por lo que se dice que en estas condiciones la pila se ha polarizado.
Otra pila basada en el mismo principio es la Pila Leclanché. En esta el electrolito es una solución de cloruro amónico (Cl NH4), siendo el electrodo negativo de zinc y el positivo una placa de carbón rodeado de una mezcla de bióxido de manganeso y carbón pulverizado introducido en un vaso de paredes porosas. El bióxido de manganeso actúa como despolarizante, parta evitar el fenómeno de la polarización citado en la pila de Volta.
La tensión de disolución del Zn hace a este disolverse formando cloruro de zinc y adquiriendo el electrodo un potencial negativo respecto a la solución. Los iones NH4+ del cloruro amónico se descargan sobre el electrodo de carbón produciendo NH3 e hidrógeno, el cual actuando sobre el bióxido de manganeso (Mn O2) lo reduce a óxido manganoso (Mn O).
Tenemos finalmente las denominadas pilas secas, que son las que normalmente utilizamos. Estas son pilas de Leclanché en las que la disolución de cloruro amónico y la mezcla de carbón y bióxido de manganeso se ha sustituido por una pasta formada por bióxido de manganeso, cloruro de zinc, carbón de cok, agua y una pequeña cantidad de grafito. El recipiente de zinc es el electrodo negativo y una barra de carbón introducida en la pasta el positivo. El cierre del recipiente se hace con una pasta no conductora que lo hace hermético.
Puesto que son fuente de energía, las baterías tienen dos parámetros fundamentales a tener en cuenta: el voltaje y la capacidad. El voltaje en la mayoría de las baterías lo tienen ajustado a 1,5 V este valor puede variarse. La capacidad de la batería viene medida en amperios hora, o más generalmente en el caso de pilas pequeñas en miliamperios hora (mAh).
A modo de ejemplo, 100 mAh indica que es posible obtener una corriente de 100 mA durante una hora (o 200 mA durante media hora) antes de que se agote la batería. Esta relación no es lineal, pues una corriente más elevada hace que se acorte la vida de la batería, mientras que una corriente más suave puede alargar la duración de la misma.
Ø Pila primaria: es una pila basada en una reacción química irreversible, y por lo tanto, es una pila no recargable (posee un solo ciclo de vida).
Ø Pila secundaria: es aquella pila basada en una reacción química reversible y, por lo tanto, es recargable. Se pueden regenerar sus elementos activos pasando una corriente eléctrica en sentido contrario al de descarga. Posee ciclos de vida múltiples.
Ø Pila botón: es una pila de tamaño reducido, de forma chata y redonda.
Ø Batería: se denomina así a una unidad productora de energía eléctrica, constituida por varias pilas.
Pila de combustible: Mecanismo electroquímico en el cual la energía de una reacción química se convierte directamente en electricidad. A diferencia de la pila eléctrica o batería, una pila de combustible no se acaba ni necesita ser recargada; funciona mientras el combustible y el oxidante le sean suministrados desde fuera de la pila
Los objetos se galvanizan para evitar la corrosión, para obtener una superficie dura o un acabado atractivo, para purificar metales (como en la refinación electrolítica del cobre), para separar metales para el análisis cuantitativo o como es el caso de la electrotipia, para reproducir un molde. Los metales que se utilizan normalmente en galvanotecnia son: cadmio, cromo, cobre, oro, níquel, plata y estaño. Las cuberterías plateadas, los accesorios cromados de automóvil y los recipientes de comida estañados son productos típicos de galvanotecnia.
domingo, 25 de noviembre de 2012
sábado, 24 de noviembre de 2012
RESUMEN SEMANA 12
UNIDAD 6. CINÉTICA QUÍMICA Y
NANOTECNOLOGÍA
6.1
Cinética química: velocidades de reacción y el mecanismo de reacción
La cinética química es un área de la
fisicoquímica que se encarga del estudio de la rapidez de reacción, cómo cambia
la rapidez de reacción bajo condiciones variables y qué eventos moleculares se
efectúan durante la reacción general (Difusión, ciencia de superficies,
catálisis). La cinética química es un estudio puramente empírico y
experimental; la química cuántica permite indagar en las mecánicas de reacción,
lo que se conoce como dinámica química.
Rapidez de reacción
La Rapidez (o velocidad) de reacción está conformada
por la rapidez de formación y la rapidez de descomposición. Esta rapidez no es
constante y depende de varios factores, como la concentración de los reactivos,
la presencia de un catalizador, la temperatura de reacción y el estado físico
de los reactivos. Uno de los factores más importantes es la concentración de
los reactivos. Cuanto más partículas existan en un volumen, más colisiones hay
entre las partículas por unidad de tiempo. Al principio, cuando la
concentración de reactivos es mayor, también es mayor la probabilidad de que se
den colisiones entre las moléculas, y la rapidez es mayor. A medida que la
reacción avanza, al ir disminuyendo la concentración de los reactivos,
disminuye la probabilidad de colisión y con ella la rapidez de la reacción. La
medida de la rapidez de reacción implica la medida de la concentración de uno
de los reactivos o productos a lo largo del tiempo, esto es, para medir la
rapidez de una reacción necesitamos medir, bien la cantidad de reactivo que
desaparece por unidad de tiempo, o bien la cantidad de producto que aparece por
unidad de tiempo. La rapidez de reacción se mide en unidades de
concentración/tiempo, esto es, en (mol/l)/s es decir moles/(l·s).
Para una reacción de la forma:
la ley de la rapidez de formación es la siguiente:
vR es la rapidez de la reacción, ( − ΔcA)
la disminución de la concentración del reactivo A en el tiempo Δt. Esta rapidez es la rapidez media de la
reacción, pues todas las moléculas necesitan tiempos distintos para reaccionar.
La rapidez de aparición del producto es igual a la
rapidez de desaparición del reactivo. De este modo, la ley de la rapidez se
puede escribir de la siguiente forma:
Este modelo necesita otras simplificaciones con
respecto a:
- La actividad química, es decir, la "concentración
efectiva"
- La cantidad de los reactivos en proporción a la cantidad de los
productos y del disolvente
- La temperatura
- La energía de colisión
- Presencia de catalizadores
- La presión parcial de gases
Orden de reacción
Para cada reacción se puede formular una ecuación, la
cual describe cuantas partículas del reactivo reaccionan entre ellas, para
formar una cantidad de partículas del producto.
Para una reacción de la forma:
esto significa, que dos partículas A colisionan con
una partícula B, una partícula C y una partícula D para formar el producto E.
Sin embargo, la probabilidad de que cinco partículas
colisionen al mismo tiempo y con energía suficiente, es escasa.
Más probable es que dos o tres partículas colisionen y
formen un producto intermedio, este producto intermedio colisiona con
las demás partículas y forma otros productos intermedios hasta formar el
producto E, aquí un ejemplo:
La descomposición de la reacción principal en llamadas
reacciones elementales y el análisis de estas nos muestra exactamente como
ocurre esta reacción.
Por medio de métodos experimentales o por premisas se
puede determinar la dependencia de la rapidez de las reacciones elementales con
las concentraciones de los componentes A, B, C y D.
El orden de reacción está definido como la suma
de los exponentes de las concentraciones en la ley rapidez de la reacción. Este
es también llamado orden total de reacción, pues el orden depende del
reactivo que se analice. El orden de la reacciones se determina
experimentalmente.
Ejemplo :
Suponiendo que la rapidez de reacción de la primera
reacción elemental tiene una dependencia cuadrática con la concentración del
reactivo A, esto significa que esta reacción es de segundo orden con respecto
al reactivo A. El orden total de esta reacción es también segundo, pues no hay
otros reactivos.
Suponiendo que la rapidez de reacción de la segunda
reacción elemental tenga una dependencia lineal con la concentración del
reactivo A2, lineal con la concentración del reactivo B y ninguna
dependencia con C. Entonces es la reacción de primer orden en relación a A2,
de primer orden en relación a B y de cero orden en relación al componente C. El
orden total es segundo.
Suponiendo que la rapidez de reacción de la tercera
reacción elemental tenga una dependencia lineal con la concentración de A2BC,
pero ninguna con la concentración de D, entonces es la reacción de primer orden
en relación a A2BC y de orden cero en relación a D. El orden total
de la reacción es primero.
Para una reacción hipotética de la forma:
la rapidez de reacción se define como:
r = k[A]a[B]b
(las concentraciones de reactivos están elevados a su
correspondiente coeficiente cinético sólo en el caso en el que la reacción sea
elemental). Donde los corchetes denotan la concentración de cada una de las
especies; "r" denota la rapidez de reacción y "k" es la
constante de rapidez. La rapidez de las reacciones químicas abarca escalas de
tiempo muy amplias. Por ejemplo, una explosión puede ocurrir en menos de un
segundo; la cocción de un alimento puede tardar minutos u horas
Factores que afectan a la rapidez de las reacciones
Existen varios factores que afectan la rapidez de una
reacción química: la concentración de los reactivos, la temperatura, la
existencia de catalizadores y la superficie de contactos tanto de los reactivos
como del catalizador. Los catalizadores pueden aumentar o disminuir la
velocidad de reacción.
Temperatura
Por norma general, la rapidez de reacción aumenta con
la temperatura porque al aumentarla incrementa la energía cinética de las
moléculas. Con mayor energía cinética, las moléculas se mueven más rápido y
chocan con más frecuencia y con más energía. El comportamiento de la constante
de rapidez o coeficiente cinético frente a la temperatura = lnA − (Ea / R)(1 /
T2 − 1 / T1) esta ecuación linealizada es muy útil y puede ser descrito a
través de la Ecuación de Arrhenius K = Aexp(
− EA / RT) donde K es la constante de la rapidez, A es el
factor de frecuencia, EA es la energía de activación necesaria y T es la
temperatura, al linealizarla se tiene que el logaritmo neperiano de la
constante de rapidez es inversamente proporcional a la temperatura, como sigue:
ln(k1 / k2) la hora de calcular la energía de activación experimentalmente, ya
que la pendiente de la recta obtenida al graficar la mencionada ley es: -EA/R,
haciendo un simple despeje se obtiene fácilmente esta energía de activación,
tomando en cuenta que el valor de la constante universal de los gases es
1.987cal/K mol. Para un buen número de reacciones químicas la rapidez se
duplica aproximadamente cada diez grados centígrados
Estado Físico
de los Reactivos
Si en una reacción interactúan reactivos en distintas
fases, su área de contacto es menor y su rapidez también es menor. En cambio,
si el área de contacto es mayor, la rapidez es mayor.
Al encontrarse los reactivos en distintas fases
aparecen nuevos factores cinéticos a analizar. La parte de la reacción química,
es decir, hay que estudiar la rapidez de transporte, pues en la mayoría de los
casos estas son mucho más lentas que la rapidez intrínseca de la reacción y son
las etapas de transporte las que determinan la cinética del proceso.
No cabe duda de que un mayor área de contacto reduce
la resistencia al transporte, pero también son muy importantes la difusividad
del reactivo en el medio, y su solubilidad, dado que esta es el límite de la
concentración del reactivo, y viene determinada por el equilibrio entre las
fases.
Presencia de
un catalizador
Los catalizadores aumentan o disminuyen la rapidez de
una reacción sin transformarse. Suelen empeorar la selectividad del proceso,
aumentando la obtención de productos no deseados. La forma de acción de los
mismos es modificando el mecanismo de reacción, empleando pasos elementales con
mayor o menor energía de activación.
Existen catalizadores homogéneos, que se encuentran en
la misma fase que los reactivos (por ejemplo, el hierro III en la
descomposición del peróxido de hidrógeno) y catalizadores heterogéneos, que se
encuentran en distinta fase (por ejemplo la malla de platino en las reacciones
de hidrogenación).
Los catalizadores también pueden retardar reacciones,
no solo acelerarlas, en este caso se suelen conocer como retardantes o
inhibidores, los cuales impiden la producción.
Concentración
de los reactivos
La mayoría de las reacciones son más rápidas en
presencia de un catalizador y cuanto más concentrados se encuentren los
reactivos, mayor frecuencia de colisión.
La obtención de una ecuación que pueda emplearse para
predecir la dependencia de la rapidez de reacción con las concentraciones de
reactivos es uno de los objetivos básicos de la cinética química. Esa ecuación,
que es determinada de forma empírica, recibe el nombre de ecuación de rapidez.
De este modo si consideramos de nuevo la reacción hipotética la rapidez de
reacción "r" puede expresarse como Los términos entre corchetes son
las molaridades de los reactivos y los exponentes m y n son coeficientes que,
salvo en el caso de una etapa elemental no tienen por que estar relacionados
con el coeficiente estequiométrico de cada uno de los reactivos. Los valores de
estos exponentes se conocen como orden de reacción.
Hay casos en que la rapidez de reacción no es función
de la concentración, en estos casos la cinética de la reacción está
condicionada por otros factores del sistema como por ejemplo la radiación
solar, o la superficie específica disponible en una reacción gas-sólido
catalítica, donde el exceso de reactivo gas hace que siempre estén ocupados
todos los centros activos del catalizador.
Presión
En una reacción química, si existe una mayor presión
en el sistema, ésta va a variar la energía cinética de las moléculas. Entonces,
si existe una mayor presión, la energía cinética de las partículas va a
aumentar y la reacción se va a volver más rápida. Excepto en los gases, que al
aumentar su presión aumenta también el movimiento de sus partículas y, por
tanto, la rapidez de reacción.
Luz
La luz es una forma de energía. Algunas reacciones, al
ser iluminadas, se producen más rapidamente, como ocurre en el caso de la
reacción entre el cloro y el hidrógeno. En general, la luz arranca electrones
de algunos átomos formando iones, con lo que aumenta considerablemente la
velocidad de reacción.
6.2
Constante de equilibrio
Donde {A} es la actividad (cantidad adimensional) de
la sustancia química A y así sucesivamente. Es solo una convención el poner las
actividades de los productos como numerador y de los reactivos como
denominadores.
Para el equilibrio en los gases, la actividad de un
componente gaseoso es el producto de los componentes de la presión parcial y
del coeficiente de fugacidad.
Para el equilibrio en una solución, la actividad es el
producto de la concentración y el coeficiente de actividad. Es una practica
común el determinar las constantes de equilibrio en un medio de fuerzas iónicas
altas. Bajo esas circunstancias, el cociente de los coeficientes de actividad
son constantes efectivamente y la constante de equilibrio es tomada para ser un
cociente de concentración.
Todas las constantes de equilibrio dependen de la
temperatura y la presión (o el volumen).
El conocimiento de las constantes de equilibrio es
esencial para el entendimiento de muchos procesos naturales como la
transportación de oxígeno por la hemoglobina en la sangre o la homeostasis
ácido-base en el cuerpo humano.
Las constantes de estabilidad, constantes de
formación, constantes de enlace, constantes de asociación y disociación son
todos tipos de constantes de equilibrio.
6.3
Principio de le chatelier
El Principio de Le Châtelier, postulado por Henri-Louis Le Châtelier (1850-1936), un químico
industrial francés, establece que:
Si un sistema químico en equilibrio experimenta un
cambio en la concentración, temperatura, volumen, o la presión parcial,
entonces el equilibrio se desplaza para contrarrestar el cambio impuesto. Este
principio es equivalente al principio de la conservación de la energía.
Factores que afectan el equilibrio químico
Concentración
Si disminuimos la concentración de un sistema en
equilibrio químico, éste se desplazará hacia el lado de la ecuación que ha sido
afectado, en cambio, si se aumenta la concentración, el equilibrio se
desplazará hacia el lado contrario de la adición. Por ejemplo:
H2 (g) + I2 (g) ←→ 2 HI (g)
<-------- (esta se desplaza hacia la izquierda para de la misma forma
disminuir la acción y equilibrar la ecuación)
Cambio de temperatura
Cuando se aumenta la temperatura en un sistema en equilibrio, este se
desplazará en el sentido que absorba el calor aplicado.
Hay dos tipos de variación con la Temperatura:
Exotérmica: que es aquella que libera o desprende calor. Por
ejemplo:
A + B ←→ C + D
+ Calor
En este caso se puede apreciar que si aumentamos la temperatura, habrá
un desplazamiento del equilibrio hacia los reactivos, ← y será hacia los
productos si se disminuye. →
Endotérmica: Es aquella que absorbe el calor. Por ejemplo:
A + B + Calor
←→ C + D
En este otro caso, se aprecia que al disminuir la temperatura afecta
visiblemente a los reactivos produciéndose un desplazamiento del equilibrio
hacia estos.← En cambio si aumentamos la temperatura se verá que el equilibrio
se irá hacia los productos. →
Es importante hacer notar que a bajas temperaturas, la reacción requiere
más tiempo, debido a que bajas temperaturas reducen la movilidad de las
partículas involucradas. Para contrarrestar este efecto se utiliza un
catalizador para acelerar la reacción.
Cambio de presión
El aumento de la presión de todo el sistema hace que el equilibrio se
desplace hacia el lado de la ecuación química que produce menos cantidad de
moles gaseosos. En el proceso contrario, al disminuir la presión el equilibrio
se desplaza hacia el lado que produce la mayor cantidad de moles gaseosos.
Lógicamente, en el caso de que las cantidades de moles gaseosos sean iguales
para cada lado de la ecuación, no se producirán cambios, es decir que el
equilibro no se desplazará. También se puede aumentar la presión del sistema
sin afectar el equilibrio agregando un gas noble.
6.4
Constante de ionización
La constante de
ionización es la constante de equilibrio de una disociación
iónica, definida inmediatamente por la ecuación de la constante de equilibrio
en función de las concentraciones molares correspondientes. Por tanto, la
constante de ionización es igual al producto de las concentraciones iónicas
dividido por a concentración de la sustancia sin disociar. Todas las sustancias
se expresan en la forma convencional de moles por litro, pero las unidades de
concentración no se ponen normalmente en forma implícita.
Las constantes de
ionización varían apreciablemente con la temperatura. A menos que se diga otra
cosa se sobrentenderá que lo temperatura es de 25°C. También se sobrentenderá
que el disolvente es el agua a menos que se establezca otra cosa.
La constante de
ionización de un ácido débil se representa normalmente por Ka. El equilibrio
para el ácido acético puede escribirse de la siguiente forma:
HC 2 H 3 O 2? H + C 2
H 3 O 2 Ka= [H] + [C 2 H 3 O 2]
[HC 2 H 3 O 2]
6.5 Producto
de solubilidad
El producto de
solubilidad de un compuesto es el producto de
las concentraciones molares de sus iones en una disolución saturada, donde cada
una de ellas se encuentra elevada a un exponente que exponente que coincide con
su coeficiente estequiométrico en la ecuación de equilibrio de disolución.
Poniendo el ejemplo del sulfato de
bario, si añadimos 1 gramo a un litro de agua, a 25ºC de temperatura, y
agitamos, para ayudar a su disolución, veremos que la mayor parte de la sal se
deposita sin disolverse, en el fondo del recipiente. Exactamente, sólo
se habrán disuelto, 0.0025 g. de BaSO4, comprobándose que se trata de una sal
muy poco soluble.
Se llega así, a una situación
peculiar e interesante, conocida como, equilibrio de solubilidad de la sal. La
disolución que se obtiene es una disolución saturada.
Debido a que se trata de un
electrolito fuerte, el sulfato de bario en disolución, se encuentra totalmente
disociado en los iones que lo forman: Ba^2+ y SO4^2-.
Por encontrarse saturada la
disolución, se produce el equilibrio entre la sal que no se ha disuelto y los
iones que están implicados en la disolución:
BaSO4 (s) ↔ Ba^2+ (aq) + SO4^2- (aq)
Ks = [A^n+]^m[B^m-]^n
La constante del producto de
solubilidad de un compuesto, trata el valor máximo que puede llegar a
tener el producto de las concentraciones de los iones que se encuentran
disueltos. Representa la medición de la solubilidad del compuesto.
El producto de solubilidad nos hace poder
predecir que ocurrirá en una disolución acuosa en la cual se encuentran
presentes iones de un compuesto en una concentración determinada. Definimos el
concepto de producto iónico, representado con la letra Q, como, el producto de
las concentraciones molares de los iones que están presentes en una disolución,
elevadas a sus coeficientes estequiométricos correspondientes en cada caso.
Por ejemplo:
Una disolución acuosa de BaSO4 a una temperatura de 25ºC, y como es una disolución saturada se establece el equilibrio:
Una disolución acuosa de BaSO4 a una temperatura de 25ºC, y como es una disolución saturada se establece el equilibrio:
BaSO4 (s) ↔ Ba^2+ (aq) + SO4^2- (aq)
El producto de solubilidad, Ks, será:
Ks = [Ba^2+].[ SO4^2-] = 1.1 . 10^-10 mol^2.L^-2
Si cuando la concentración de los
iones que se encuentran involucrados en la disolución, en un momento dado son:
[Ba^2+]0 y [ SO4^2-]0 , el producto iónico Q, será:
Q = [Ba^2+]0 y [
SO4^2-]0
La expresión del producto iónico, Q,
es idéntica a la del producto de solubilidad, Ks, pero con diferentes
concentraciones de las que se encuentran en el equilibrio.
Se pueden comparar los valores de Q
y de Ks, para así, poder predecir el comportamiento de la disolución:
- Cuando Q
< Ks : La disolución se encuentra insaturada, pudiendo
disolverse aún más sólido en ella. Se ve favorecido el desplazamiento
hacia la derecha en el equilibrio de solubilidad.
- Cuando Q=
Ks : La disolución se encuentra saturada, y por tanto el sistema
se encuentra en equilibrio.
- Cuando Q>
Ks : Se ve favorecido el desplazamiento hacia la izquierda
del equilibrio de la solubilidad, produciéndose la precipitación del
exceso de la concentración, hasta que Q sea igual a Ks
6.6
Solución amortiguadora (buffer)
Disolución Amortiguadora
Para que uno se
conserve saludable, hay muchos fluidos en cada uno de nuestros cuerpos que se
deben mantener dentro de unos límites muy estrechos de pH. Para que este
objetivo se realice, se crea un sistema amortiguador.
Un sistema
amortiguador es una solución que puede absorber grandes cantidades moderadas de
ácidos o bases, sin un cambio significativo en su pH, es decir, es una
disolución que contiene unas sustancias que inhiben los cambios de HP, o
concentración de ion hidrógeno de la disolución. Dichas sustancias pueden
contener un ácido débil y su sal, por ejemplo, ácido acético y acetato de
sodio, o una base débil
y una sal de esa base, por ejemplo, hidróxido de amonio y cloruro de
amonio. Los fluidos de los organismos vivos están fuertemente tamponados, y el
agua del mar y ciertas sustancias del suelo son otros ejemplos de disoluciones
tampones existentes en la naturaleza. Las disoluciones tampones se utilizan en
química y sirven como referencia en la medida del pH.
Consideremos la
reacción del amoniaco en agua:
NH3 (g) + H2O ! NH4+ (ac) + OH- (ac)
Si observamos la
reacción inversa en este equilibrio, veremos que los iones amonio reaccionan
con una base. Pero si disolvemos iones amonio (del cloruro de amonio) en agua
ocurre:
NH4+ (ac) + H2O (l) !
NH3 (ac) + H3O- (ac)
De esta reacción
inversa, podemos ver que las moléculas de amoniaco reaccionan con los ácidos.
Si tuviésemos una solución con suficientes cantidades de cada una de estas
sustancias, los iones amonio y las moléculas de amoniaco, tendríamos la deseada
solución amortiguadora. Las moléculas del amoniaco reaccionarían con cualquier
ácido que se añadiese, y los iones amonio reaccionarían con cualquier base que
se añadiese. Las soluciones amortiguadoras se preparan utilizando un ácido
débil o una base débil con una de sus sales. En términos generales, las
reacciones aparecerían de la siguiente forma:
- Para un ácido
débil: HA + OH- ! H2O + A- A- + H3O+ ! HA + H2O
El ácido débil (HA),
reacciona con la base que se añade. El ion negativo de la sal (A-), reaccionara
con el ácido que se añade.
- Para una base
débil: MOH + H3O+ ! M+ + 2H2O M+ + OH- ! MOH
La base débil (MOH),
reaccionara con el ácido que se añade. El ion positivo de la sal, (M+),
reaccionara con la base que se añade.
Los amortiguadores
tienen máxima eficiencia para neutralizar los ácidos y las bases que se añaden,
cuando las concentraciones del ácido débil (o de la base) y de la sal son
iguales. Podremos preparar una solución amortiguadora de casi cualquier pH, si
escogemos el ácido (o base) débil correcto. Existe un ion común entre el
electrolito débil y su sal. El comportamiento de una solución amortiguadora
puede ser explicado siempre tomando como base nuestro conocimiento acerca del
efecto del ion común y el Principio de Le Chatelier, el cual dice que si un
producto o subproducto es eliminado del sistema, el equilibrio se verá
perturbado y la reacción producirá más producto con el objeto de compensar la
pérdida. En las polimerizaciones, este truco es usado para hacer que las
reacciones alcancen altas conversiones.
La sangre esta
amortiguada, principalmente, por el ion bicarbonato (HCO3-), pero cuando ocurre
la hiperventilación que se trata de un estado de sobre respiración, causado por
el miedo, la excitación o la ansiedad, ya que al ocurrir este proceso una
persona expele más dióxido de carbono de lo necesario, alterando el equilibrio
del acido carbónico.
Disolución
Amortiguadora, Tampón o Buffer
14.-) Defina solución
amortiguadora. ¡Cuáles son sus componentes!
Es una solución de un
ácido débil o una base débil y su sal. Los dos componentes deben estar
presentes.
La disolución tiene
la capacidad de resistir los cambios de pH cuando se agregan pequeñas
cantidades tanto de ácidos como de bases.
La disolución
amortiguadora está compuesta por un ácido o una base y una sal.
15.-) Cite dos
ejemplos donde se ponga en evidencia la importancia de las soluciones
amortiguadoras:
las disoluciones
amortiguadoras son muy importantes en los sistemas químicos y biológicas.
El pH en el cuerpo
humano varía mucho de un fluido de a otro; por ejemplo, el pH de la sangre es
alrededor de 7,4, en tanto que el del jugo gástrico humano es de alrededor de
1,5.
En la mayor parte de
los casos, estos valores de pH, que son cítricas para el funcionamiento
adecuado de las enzimas y del balance de la presión osmótica, se mantienen
gracias a las disoluciones amortiguadoras.
Una solución que
contiene moléculas de ácido acético y iones acetato (además, por supuesto, de
otros iones). El equilibrio principal en esta solución es:
HC 2 H 3 O 2? H++ÛC 2 H 3 O 2-
6.7. TENDENCIAS DE LA NANOTECNOLOGÍA: MATERIALES Y SUS CARACTERÍSTICAS.
Tendencias de la nanotecnología
La mejor definición de Nanotecnología que hemos encontrado es esta: La nanotecnología es el estudio, diseño, creación, síntesis, manipulación y aplicación de materiales, aparatos y sistemas funcionales a través del control de la materia a nano escala, y la explotación de fenómenos y propiedades de la materia a nano escala.
Cuando se manipula la materia a la escala tan minúscula de átomos y moléculas, demuestra fenómenos y propiedades totalmente nuevas. Por lo tanto, científicos utilizan la nanotecnología para crear materiales, aparatos y sistemas novedosos y poco costosos con propiedades únicas
La nano ciencia está unida en gran medida desde la década de los 80 con Drexler y sus aportaciones a la “nanotecnología molecular", esto es, la construcción de nano máquinas hechas de átomos y que son capaces de construir ellas mismas otros componentes moleculares.
Los estudios científicos sobre la miniaturización de la tecnología han dado a conocer importantes descubrimientos que han ayudado al desarrollo y evolución de la humanidad, haciendo de todas sus áreas una forma de vida más sencilla y útil, ¿pero hasta donde puede llegar la evolución de la tecnología? Siendo ahora la oportunidad de la nanotecnología como el estudio, diseño y aplicación de materiales, a través del control de la materia a nano escala, y la explotación de fenómenos y propiedades de la materia a esta misma medida.
Cabe aclarar que el termino nano es un prefijo que indica una medida mas no un objeto y un nanómetro es la mil millonésima escala de un metro, caracterizando a la nanotecnología por su desarrollo de nuevas tendencias y experimentos por medio de la manipulación de átomos y partículas casi invisibles y como un campo esencialmente multidisciplinar, inicialmente impulsada por la electrónica, en su urgencia de superar los límites de tamaño que marca la utilización de silicio en los circuitos integrados; ahora la nanotecnología está siendo utilizada en muchos productos que tienen que ver con la medicina en el diagnostico y tratamiento de terapias por medio de moléculas que se puedan adaptar al cuerpo humano, siendo su tamaño más pequeño que los glóbulos rojos, interviniendo entre los torrentes sanguíneos para cumplir la función de eliminar células malignas causantes de las enfermedades más letales como el cáncer.
No solo ha sido impulsada por la electrónica y la medicina, la nanotecnología también tiene sus aplicaciones en la Nano informática, los Nano satélites y los Nano robots, que han sido de gran utilidad e importancia para su desarrollo, sobre todo en el campo de la computación y las comunicaciones, quienes han formado gran parte de este proceso.
La nanotecnología es la aplicación de la ciencia de los sistemas a escala manométrica.
Un nanómetro (nm.) es la millonésima parte de un milímetro; las dimensiones de los sistemas de escala manométrica oscilan entre 1 y 100 nm.
Es un régimen en el que la física, la química y la biología convergen para crear la "nano ciencia".
Nano- es un prefijo griego que indica una medida, no un objeto.
La nanotecnología promete soluciones vanguardistas y más eficientes para los problemas ambientales.
La nanotecnología avanzada, a veces también llamada fabricación molecular, es un término dado al concepto de ingeniería de nano sistemas (máquinas a escala manométrica).
La nanotecnología es el estudio, diseño, creación, síntesis, manipulación y aplicación de materiales, aparatos y sistemas funcionales a través del control de la materia a nano escala.
La nano informática
la enorme importancia que tendrá la informática en el futuro inmediato de la medicina de vanguardia y destacan la creación de un área, la nano informática transnacional, a través de la cual los avances en la investigación básica en nano medicina podrán tener aplicaciones clínicas de importancia creciente. Esta nueva disciplina, analiza los últimos trabajos en nano informática, incluyendo sus aplicaciones en pediatría, al mismo tiempo que estudia sus bases científicas y las investigaciones y proyectos en este campo, incluyendo sus aplicaciones y potenciales problemas.
Nano medicina en expansión
Señalan asimismo que la nano medicina se encuentra todavía en los primeros estadios de su desarrollo, si bien algunas nano partículas y nano dispositivos han sido aprobados ya, o están a punto de hacerlo, por la Food and Drug Administration de Estados Unidos. Por ejemplo, nano partículas supe magnéticas para detectar metástasis en algunos tipos de cáncer, o nuevos dispositivos que combinan micro fluido o nano sensores para la detección de tumores.
Estas aplicaciones de los nano materiales ofrecen nuevas perspectivas para la medicina personalizada, añaden los autores, especificando que los estudios clásicos de medicina deben ser rediseñados para adaptarlos a los avances que se producen en genómica, proteómica y la farmacogenética. “La introducción de nano partículas que pueden alcanzar diferentes moléculas o grupos de átomos con gran precisión, puede provocar significativos avances en la personalización de los procesos clínicos”
Una barrera nanotecnológica
Desarrollado una nueva manera para proteger dispositivos electrónicos contra la humedad. Esta protección, en forma de una película nanotecnológica, es 1.000 veces más impermeable al vapor de agua que otras técnicas usadas hasta ahora. Según sus creadores, esta nueva tecnología será muy útil particularmente para dispositivos delicados basados en la electrónica orgánica, como células solares o pantallas flexibles, que usan para su protección películas muy sofisticas y caras, pero que terminan por degradarse debido a la influencia de la humedad, del vapor de agua y el oxígeno.
Armaduras de nanotubos de carbono
Los investigadores dicen que su material es varias veces más fuerte, más duro y rígido que las fibras que se utilizan actualmente para hacer corazas de protección. Pero además, mucho más ligero, ya que está confeccionada por millones de diminutos nanotubos de carbono, que le confiere unas extraordinarias propiedades.
La mejor definición de Nanotecnología que hemos encontrado es esta: La nanotecnología es el estudio, diseño, creación, síntesis, manipulación y aplicación de materiales, aparatos y sistemas funcionales a través del control de la materia a nano escala, y la explotación de fenómenos y propiedades de la materia a nano escala.
Cuando se manipula la materia a la escala tan minúscula de átomos y moléculas, demuestra fenómenos y propiedades totalmente nuevas. Por lo tanto, científicos utilizan la nanotecnología para crear materiales, aparatos y sistemas novedosos y poco costosos con propiedades únicas
La nano ciencia está unida en gran medida desde la década de los 80 con Drexler y sus aportaciones a la “nanotecnología molecular", esto es, la construcción de nano máquinas hechas de átomos y que son capaces de construir ellas mismas otros componentes moleculares.
Los estudios científicos sobre la miniaturización de la tecnología han dado a conocer importantes descubrimientos que han ayudado al desarrollo y evolución de la humanidad, haciendo de todas sus áreas una forma de vida más sencilla y útil, ¿pero hasta donde puede llegar la evolución de la tecnología? Siendo ahora la oportunidad de la nanotecnología como el estudio, diseño y aplicación de materiales, a través del control de la materia a nano escala, y la explotación de fenómenos y propiedades de la materia a esta misma medida.
Cabe aclarar que el termino nano es un prefijo que indica una medida mas no un objeto y un nanómetro es la mil millonésima escala de un metro, caracterizando a la nanotecnología por su desarrollo de nuevas tendencias y experimentos por medio de la manipulación de átomos y partículas casi invisibles y como un campo esencialmente multidisciplinar, inicialmente impulsada por la electrónica, en su urgencia de superar los límites de tamaño que marca la utilización de silicio en los circuitos integrados; ahora la nanotecnología está siendo utilizada en muchos productos que tienen que ver con la medicina en el diagnostico y tratamiento de terapias por medio de moléculas que se puedan adaptar al cuerpo humano, siendo su tamaño más pequeño que los glóbulos rojos, interviniendo entre los torrentes sanguíneos para cumplir la función de eliminar células malignas causantes de las enfermedades más letales como el cáncer.
No solo ha sido impulsada por la electrónica y la medicina, la nanotecnología también tiene sus aplicaciones en la Nano informática, los Nano satélites y los Nano robots, que han sido de gran utilidad e importancia para su desarrollo, sobre todo en el campo de la computación y las comunicaciones, quienes han formado gran parte de este proceso.
La nanotecnología es la aplicación de la ciencia de los sistemas a escala manométrica.
Un nanómetro (nm.) es la millonésima parte de un milímetro; las dimensiones de los sistemas de escala manométrica oscilan entre 1 y 100 nm.
Es un régimen en el que la física, la química y la biología convergen para crear la "nano ciencia".
Nano- es un prefijo griego que indica una medida, no un objeto.
La nanotecnología promete soluciones vanguardistas y más eficientes para los problemas ambientales.
La nanotecnología avanzada, a veces también llamada fabricación molecular, es un término dado al concepto de ingeniería de nano sistemas (máquinas a escala manométrica).
La nanotecnología es el estudio, diseño, creación, síntesis, manipulación y aplicación de materiales, aparatos y sistemas funcionales a través del control de la materia a nano escala.
La nano informática
la enorme importancia que tendrá la informática en el futuro inmediato de la medicina de vanguardia y destacan la creación de un área, la nano informática transnacional, a través de la cual los avances en la investigación básica en nano medicina podrán tener aplicaciones clínicas de importancia creciente. Esta nueva disciplina, analiza los últimos trabajos en nano informática, incluyendo sus aplicaciones en pediatría, al mismo tiempo que estudia sus bases científicas y las investigaciones y proyectos en este campo, incluyendo sus aplicaciones y potenciales problemas.
Nano medicina en expansión
Señalan asimismo que la nano medicina se encuentra todavía en los primeros estadios de su desarrollo, si bien algunas nano partículas y nano dispositivos han sido aprobados ya, o están a punto de hacerlo, por la Food and Drug Administration de Estados Unidos. Por ejemplo, nano partículas supe magnéticas para detectar metástasis en algunos tipos de cáncer, o nuevos dispositivos que combinan micro fluido o nano sensores para la detección de tumores.
Estas aplicaciones de los nano materiales ofrecen nuevas perspectivas para la medicina personalizada, añaden los autores, especificando que los estudios clásicos de medicina deben ser rediseñados para adaptarlos a los avances que se producen en genómica, proteómica y la farmacogenética. “La introducción de nano partículas que pueden alcanzar diferentes moléculas o grupos de átomos con gran precisión, puede provocar significativos avances en la personalización de los procesos clínicos”
Una barrera nanotecnológica
Desarrollado una nueva manera para proteger dispositivos electrónicos contra la humedad. Esta protección, en forma de una película nanotecnológica, es 1.000 veces más impermeable al vapor de agua que otras técnicas usadas hasta ahora. Según sus creadores, esta nueva tecnología será muy útil particularmente para dispositivos delicados basados en la electrónica orgánica, como células solares o pantallas flexibles, que usan para su protección películas muy sofisticas y caras, pero que terminan por degradarse debido a la influencia de la humedad, del vapor de agua y el oxígeno.
Armaduras de nanotubos de carbono
Los investigadores dicen que su material es varias veces más fuerte, más duro y rígido que las fibras que se utilizan actualmente para hacer corazas de protección. Pero además, mucho más ligero, ya que está confeccionada por millones de diminutos nanotubos de carbono, que le confiere unas extraordinarias propiedades.
Suscribirse a:
Comentarios (Atom)